宿主细胞DNA残留的担忧是基于致ai风险理论,特别是生产细胞系所包含的致ai序列,比如较常见腺病毒基因E1A和E1B(HEK293, PerC.6 和CAP 细胞系),人乳tou瘤病毒E6和E7基因(HeLa细胞系)等。当使用致ai细胞系生产AAV时,下游纯化须尽可能减少残留DNA。工业上一般使用核酸酶分解残留DNA,普遍认为小于200 bp的DNA片段可有效降低致ai风险。宿主细胞蛋白残留与免疫原性、炎症或过敏性休克有关。尽管与非人类的生产原料相比(非人类细胞系如BHK21或昆虫细胞,以及辅助病毒如HSV、腺病毒、杆状病毒),人类细胞免疫原性比较弱。SAN HQ高盐核酸酶的检测标准,都符合USP-EP要求。福建500mM盐浓度条件高盐核酸酶70921
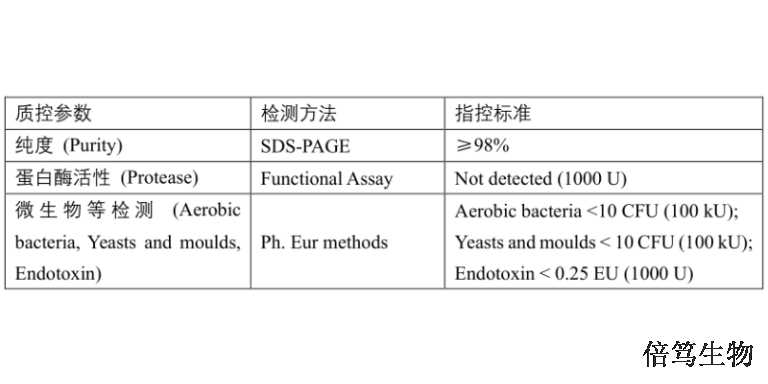
经典的慢病毒载体(LV)的生产工艺如下,——三质粒系统瞬时转染HEK293细胞系,转染24小时后LV由转染阳性细胞生产并排出到培养上清液中;收获上清培养液后,加入核酸酶去除HCD污染,通过澄清步骤去除大的细胞碎片等杂质;下游纯化步骤分离LV载体,纯化方法包括切向流过滤TFF、色谱纯化及超速离心;纯化后的LV病毒颗粒经过无菌过滤,更换到优化后的配方中,灌装并冷冻保存。每批Car-T生产时取对应量的LV病毒,切忌反复冻融,否则LV病毒会失活。黑龙江高盐条件高盐核酸酶70921-150SAN HQ终产品经过0.22 µm过滤除菌;

杆状病毒表达载体体系Baculovirus/Sf9(Baculovirusexpression vector,BEV),是应用杆状病毒表达载体(BEV)系统infect昆虫细胞Sf9,是一种替代哺乳动物包装细胞系的生产方案。整个系统包含两种BEV,其中一个BEV携带两侧有ITRs的目的基因,另一BEV则携带rep/cap基因。这两种BEV同时infectSf9即可组装AAV。由于杆状病毒具有辅助功能,因此BEV系统与可以稳定表达rep的Sf9细胞相结合,可用于灵活的、高滴度的大规模载体生产。BEV体系安全性好,infection效率高,生产工艺较之sTT更易放大,有更高的体积生产率优势。
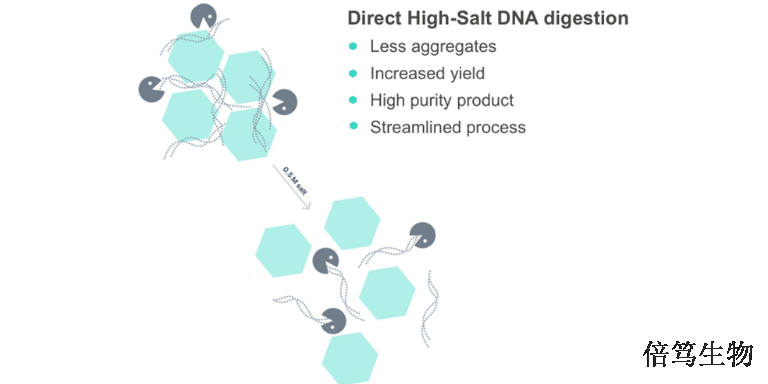
在生物工艺中,核酸酶的主要作用是高效消化宿主细胞DNA(HCD),并将其分解成足够小的片段,以便在下游纯化过程中去除。虽然大多数核酸酶可以在生理盐条件下高效地将裸DNA降解成微小片段,比如Benzonase和SANs都可以把dsDNA分解成小于8nt的寡核苷酸链,但实际生产中的核酸污染情况更加复杂。HCD通常以染色质形式存在,与细胞裂解碎片、病毒颗粒等结合在一起,影响核酸酶的识别及剪切。因此,HCD去除的关键在于——核酸酶如何在复杂的生产体系中识别并剪切HCD。SAN HQ应用于生产工艺流程中,有效去除核酸污染;截止目前,已用于全球20+临床项目中。
从国内来看,由于 AAV 基因药物研发管线绝大部分集中在眼科遗传病上,载体用量较小,三质粒共转染 AAV 系统足以满足未来的临床及商业需求,因此,国内的 AAV 生产系统主要以三质粒为主。然而,考虑到未来 AAV 基因药物在血液、神经系统、肌肉系统等领域的临床应用,三质粒系统显然难以胜任。如药明生基从国外收购了 OXGENE 的辅助腺病毒 AAV 生产系统 TESSA,据报道较三质粒系统有10倍的提升;而基因药物 CDMO 企业北京五加和基因则在国内率先采用了陈海峰博士的威洛克公司授权的Bac-to-AAV 系统,凭借公司在病毒载体领域持续30年的研发经验,不断摸索、试验,终于在临床级生产方面获得了巨大的成功,为 AAV 基因药物管线研发公司锦篮基因进行多批次临床 CDMO 代工生产。SAN HQ高盐核酸酶有两个级别,分别是生物工艺级别SAN HQ和GMP级别SAN HQ GMP。海南高盐条件高盐核酸酶
ArcticZymes厂家管控整个供应链及生产流程,协助客户进行文件审计及现场审计。福建500mM盐浓度条件高盐核酸酶70921
通过三质粒瞬转体系生产病毒载体,会引入宿主细胞DNA残留(HCD)、蛋白残留(HCP)、工艺杂质(如antibiotics、核酸酶等外源物质)等污染,存在潜在的致瘤性和免疫原性等风险。药品监管机构一般允许生物制品中存在10ng/dose以下的残留DNA。此外,根据杂质来源、工艺以及产品类型不同,也会对HCD限度做不同要求。为了达到这个要求,一般通过核酸酶处理和色谱联用的方法。一般在细胞培养液裂解/收获、澄清收获及超滤浓缩等环节加入核酸酶处理,需要工艺摸索来确认处理方式。福建500mM盐浓度条件高盐核酸酶70921
ArcticZymes Technologies产品大都来源于深海microbes中,具有一些共同的...
【详情】综合腺相关病毒AAV制备的三个工艺阶段介绍,可以看出下游处理可以占病毒生产总成本的很大一部分,而且难...
【详情】ArcticZymes Technologies产品大都来源于深海microbes中,具有一些共同的...
【详情】ArcticZymes Technologies致力于提供高质量产品,具有良好的批间一致性、稳定可靠...
【详情】由于Triton X-100的降解产物对环境影响很大,自2023年12月22日起,欧盟将禁止使用Tr...
【详情】从细胞中释放AAV载体的基本机械技术是反复冷冻/解冻,然后是低速离心步骤然而,但是这种技术很难放大生...
【详情】一个美国客户做了对照实验,比较Benzonase和SAN HQ高盐核酸酶纯化病毒载体的效率。实验设计...
【详情】在生物工艺中,核酸酶的主要作用是高效消化宿主细胞DNA(HCD),并将其分解成足够小的片段,以便在下...
【详情】ArcticZymes Technologies成立于20世纪80年代后期,总部位于挪威北部的特罗姆...
【详情】ArcticZymes厂家对盐活性核酸酶系列产品(Salt Active Nucleases,SAN...
【详情】离子交换层析 (IEC) 是一种简单、通用且经济高效的技术,已成为许多载体纯化的关键步骤。IEC分为...
【详情】三种AAV载体的生产体系(三质粒瞬转体系、杆状病毒表达载体体系以及包装细胞体系) 中都会出现三种衣壳...
【详情】