- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
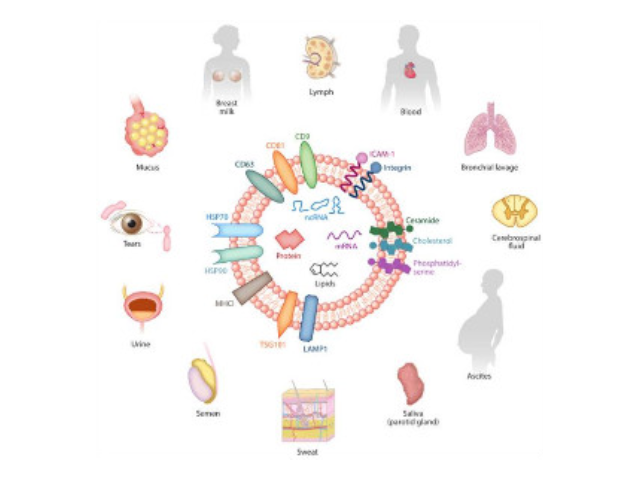
外泌体是一种存在于细胞外的多囊泡体,可通过细胞内吞泡膜向内凹陷形成多泡内涵体,内涵体与细胞膜融合后释放其中的小囊泡。外泌体的直径在40-110nm之间,其中包含RNA、蛋白质、microRNA等多种物质,存在于血液、唾液、尿液、脑脊液和母乳等多种体液中。外泌体从发现至今已有30多年的历史,虽然较初被认为可能是细胞的“垃圾”,所以才被排出来,但是近年来研究表明外泌体具有功能活性并可进行细胞间信息传递。如今,研究已经发现外泌体在抗原提呈细胞中呈递抗原程中、一些病症细胞发生的发展、神经细胞信号转导过程中都发挥着重要作用。利用化合物沉淀将法外泌体沉淀出来。外泌体提取色谱法是利用根据凝胶孔隙的孔径大小与样品分子尺寸的相对关系而对溶质进行分离的分析的方法。珠海外泌体提取试剂报价

外泌体的提取、分离方法:尺寸排阻色谱法和超滤法;尺寸排阻色谱法是利用分子筛理论,较初是根据蛋白质分子大小分离蛋白质的色谱技术。该方法的主要优点是不需要很大的离心力,从而保证了外泌体的完整性。Mol等[13]对比超高速离心和尺寸排阻色谱法得到的外泌体蛋白,结果显示,后者得到的外泌体的蛋白丰度高于前者。这些基于过滤或尺寸排阻色谱的新方法为外泌体大规模的生产和临床应用提供了可能。超滤也是根据外泌体的尺寸将其分离出来的一种方法,超滤一般被认为是外泌体分离过程中的一个准备过程,通过超滤除去大分子和小分子的蛋白质。不过连续的超滤可以分离出外泌体,和超高速离心相比,超滤不需要特殊的设备就可以较短时间内分离出外泌体。但是,超滤膜对外泌体的黏附作用会降低外泌体的产量,并且超滤过程中施加的外力可能会使外泌体变形或者破裂。芜湖外泌体提取试剂厂家批发价外泌体提取:使用抗体包被珠子的分离不适合从大量样本中获得外泌体。
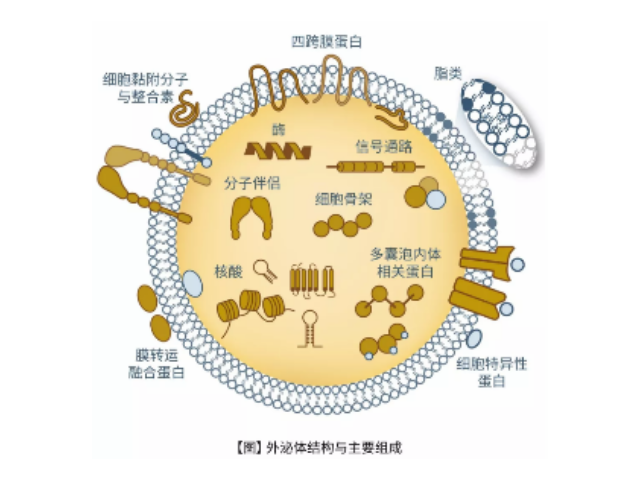
外泌体的功能取决于其所来源的细胞类型,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、一些病症侵袭等方方面面。有研究表明一些病症来源的外泌体参与到一些病症细胞与基底细胞的遗传信息的交换,从而导致大量新生血管的生成,促进了一些病症的生长与侵袭。功能:当外泌体在1980年初次被发现后,其被认为是细胞排泄废物的一种方式,如今随着大量对其生物来源、其物质构成及运输、细胞间信号的传导以及在体液中的分布的研究发现外泌体具有多种多样的功能。
外泌体提纯试剂盒的特色与优势:纯化和富集的完整血浆/血清,尿液和细胞培养基中外泌体的可用于功能研究;样本输入量多样;无需耗时的超速离心,过滤或特殊注射器;无需沉淀试剂,也无需过夜培养;无需蛋白酶处理;适用于多种物种;外泌体被纯化并且不含任何其他RNA结合蛋白;可以使用NanoSight®或电子显微镜分析纯化的外泌体,以评估近似外泌体大小范围和浓度。外泌体(exosomes)是一种能被机体内大多数细胞分泌的直径大约为30~150nm的具有脂质双层膜的微小膜泡。它普遍存在并分布于各种体液中,携带和传递重要的信号分子,形成了一种全新的细胞间信息传递系统,影响细胞的生理状态并与多种疾病的发生与进程密切相关。外泌体提取:高速离心以消除更大的囊泡。
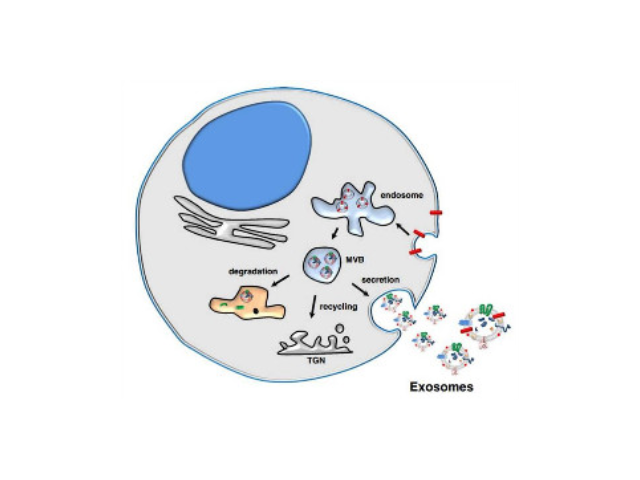
外泌体的提取方法:1、磁珠免疫法。外泌体表面有其特异性标记物(如CD63、CD9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。磁珠法具有特异性高、操作简便、不影响外泌体形态完整等优点,但是效率低,外泌体生物活性易受pH和盐浓度影响,不利于下游实验,难以普遍普及。2、多聚物沉淀法。聚乙二醇(PEG)为常用的多聚物,可与疏水性蛋白和脂质分子结合共沉淀,早先应用于从血清等样本中收集病毒,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。利用PEG沉淀外泌体存在不少问题:比如纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20等化学添加物将会破坏外泌体等。外泌体提取:尺寸排阻色谱。尺寸排阻色谱是基于大小而非分子量实现分离大分子。珠海外泌体提取试剂报价
外泌体(Exosome)发现于1986年,是一种直径约30~100nm的双层膜囊泡状结构小体。珠海外泌体提取试剂报价
CD47是信号调节蛋白α(SIRPα,也称为CD172a)的配体,CD47-SIRPα间的结合能够发出“不要吃我”的信号,从而压制吞噬作用。病基因RAS能够促进胰腺病细胞增殖,增强胞饮作用从而促进一些病症细胞摄取外泌体。合成纳米颗粒对细胞有一定毒性作用,但使用外泌体能够较小化对细胞的毒性。研究人员发现,CD47和病基因KRAS驱动的胞饮作用都会压制外泌体被循环系统的清理,并增强胰腺病细胞对外泌体的特异性。所以,外泌体的这种特性增强了它们通过递送RNAi来特异性靶向胰腺病中的KRAS的能力,并且使用外泌体作为单一靶向剂显着改善了所有实验PDAC小鼠模型的总生存期。珠海外泌体提取试剂报价
外泌体的提取方法学规范、统一定量及鉴定等。关于外泌体的提取有超速离心、试剂盒、超滤法、蔗糖密度梯度离心等,然而各种方法均有其利弊。超速离心法是目前外泌体相关文章中的主流方法,由于离心步骤繁琐,费事费力,而且步骤多导致实验中容易污染,且损耗量大,使得较终回收的外泌体不稳定。而且对于抽提细胞上清来说,更是极为不请便,试想用提取300ml的上清需要6个50ml离心管,无论是过滤还是后续的每一步的离心去沉淀,都具有操作极其不便的缺点,总之非常麻烦。而超滤法存在外泌体会堵塞膜孔,造成浓缩效率低,浓缩管重复利用差,甚至堵塞在膜孔的外泌体还可能会粘连成团,造成损失及较后的数据有误差,对于后续实验也有影响无法...
- 温州正规外泌体提取试剂报价 2024-11-14
- 温州正规外泌体提取试剂销售厂家 2024-11-13
- 南京正规外泌体提取试剂服务电话 2024-11-13
- 上海外泌体提取试剂哪家好 2024-11-13
- 深圳外泌体提取试剂哪家便宜 2024-11-13
- 重庆外泌体提取试剂厂家批发价 2024-11-13
- 重庆外泌体提取试剂哪家好 2024-11-13
- 珠海外泌体提取试剂产品介绍 2024-11-13
- 杭州外泌体提取试剂哪家好 2024-11-13
- 郑州外泌体提取试剂哪家好 2024-11-13
- 南京外泌体提取试剂哪家便宜 2024-11-11
- 杭州正规外泌体提取试剂厂家批发价 2024-11-11
- 广州正规外泌体提取试剂报价 2024-11-11
- 徐州正规外泌体提取试剂报价 2024-11-11
- 昆明正规外泌体提取试剂厂家直销 2024-11-11
- 芜湖外泌体提取试剂报价 2024-11-11


- 济南RNA提取试剂平均价格 11-22
- 重庆RNA提取试剂生产厂家 11-22
- 昆明正规RNA提取试剂厂家直销 11-22
- 广州RNA提取试剂厂家直销 11-22
- 开封RNA提取试剂哪家好 11-22
- 天津正规RNA提取试剂厂家现货 11-22
- 厦门RNA提取试剂厂家供应 11-22
- 厦门正规RNA提取试剂直销厂家 11-22
- 杭州RNA提取试剂价格 11-22
- 青岛正规RNA提取试剂哪家好 11-22