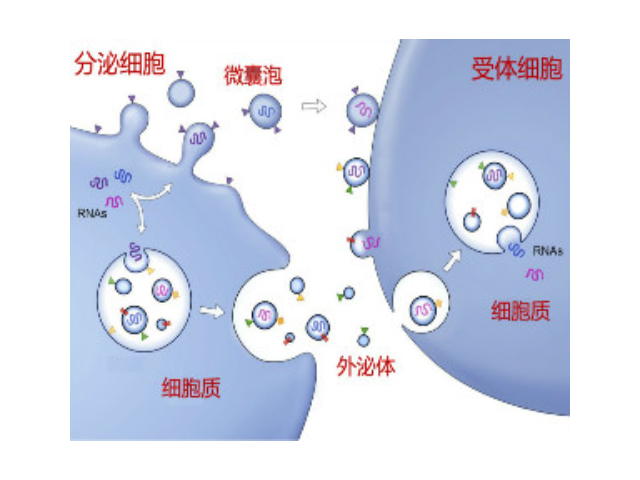
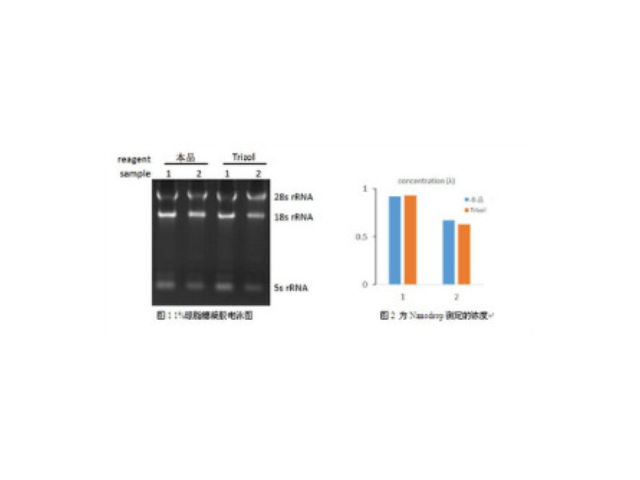
- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
如何有效提高细胞转染实验效率:1.选择合适的转染试剂不同细胞系转染效率通常不同,但细胞系的选择通常是根据实验的需要,因此在转染实验前应根据实验要求和细胞特性选择适合的转染试剂。每种转染试剂都会提供一些已经成功转染的细胞株列表和文献,通过这些资料可选择较适合实验设计的转染试剂。当然,较适合的是高效、低毒、方便、廉价的转染试剂。2.保持较佳的细胞状态一般低的细胞代数(<50)能确保基因型不变。较适合转染的细胞是经过几次传代后达到指数生长期的细胞,细胞生长旺盛,较容易转染。细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。也就是说同一种系的细胞株,在各实验室不同培养条件下,其生物学性状发生不同程度的改变,导致其转染特性也发生变化。因此,如果发现转染效率降低,可以试着转染新鲜培养的细胞以恢复较佳结果。有血清时的转染 血清一度曾被认为会降低转染效率。合肥细胞高效转染试剂推荐厂家

转染的注意事项:用于蛋白生产的细胞的转染可以在添加有血清或无血清培养基中进行。但更倾向于使用无血清培养基表达蛋白,因为血清蛋白会干扰下游表达蛋白的纯化。无血清培养基一般针对某一特定细胞类型优化并有几类无血清培养基不需要添加血清,一般含有不均一的或大量的蛋白(但比添加血清的培养基低得多)。无蛋白培养基不含蛋白但可能含有不明成分的抽提物,限定化学成分的培养基不含有蛋白或未知组成的成分。多种多样的配方使您可以选择较适合您应用的一种。在含血清时转染的细胞可以适应无血清培养基,无蛋白培养基或限定化学成分的培养基。在部分情况下(如293-F,293-H,COS-7和CHO-S),对于已适应无血清或无蛋白培养基的细胞,可以使用其培养基进行转染。其他一些无血清培养基包含克制阴离子脂质体介导转染的成分,在这些情况下,有必要在诸如D-MEM或OPTI-MEMⅠ等培养基中进行培养和转染。合肥细胞高效转染试剂推荐厂家细胞易于生长到高密度并合成更多蛋白。

细胞转染之PEI 转染法:1.细胞分盘:通过胰酶消化收集细胞,用适当的完全培养基以 1×105 至 4×105细胞/cm2 的密度平铺细胞于 35 mm 培养皿上(根据实验需要选择培养皿,使细胞贴壁后所占面积达到培养皿总面积的 70-90%)。将细胞置于含 5%CO2 的 37℃温箱中孵育 8-24 h,当细胞贴壁完全后即可开始转染。转染前 2 h 换液(用 1.5 ml 无血清培养基置换旧的培养基)。注:PEI转染法对细胞生长有克制作用,在换液前细胞几乎不生长,所以需要密度比较大时做转染。2.制备PEI-DNA 混合物以 35 mm 组织培养皿用 240 μl 反应总体积为例。先在无菌EP管中加入120 μl 1×HBS,再加入质粒 DNA(总量 1-3 μg 为佳),混匀后加入等体积 PEI工作液,充分混匀后室温静置 20-30 min ,较后将这 240 μl 的PEI-DNA混合液逐滴加入上述单层细胞的细胞培养基中,轻轻摇动平皿混匀后置于含 5% CO2的 37℃温箱孵育。
细胞转染效率低下的几个大坑:1.试剂过期有时候转染效率低下,还要考虑会不会存在试剂过期的情况。毛博当年做转染整整半年,百思不得其解。较后发现,原来是Lipofectamine 2000过期了。换了之后,立马成功。根据我的经验,尽量使用开封半年内的,因为过了半年后,就算没有过失效期,但是细胞毒性较大增加,而转染效率却较大下降。千万不要为了省钱,影响实验进度哈。2.未加血清转染后未及时加入血清,会导致细胞大量死亡。一般要在转染后的4-6小时换液且换为有血清的培养基。根据毛博的经验,其实也可以在原来的无血清培养基里面滴加血清。这个时候,较好不要换液,不要打扰细胞,让它安安静静地休息。但是也不能过早加入血清。过早的话,会引起未转染的细胞疯狂生长。那么,什么是较佳时机呢?在20%的细胞变圆的时候,就是加血清的较佳时机。瞬时转染后,可在48h-72h细胞长满之后,提取细胞蛋白或者RNA。

转染的注意事项:细胞铺板密度用于转染的较佳细胞密度根据不同的细胞类型或应用而异。一般转染时,贴壁细胞密度为70%-90%,悬浮细胞密度为2×106-4×106细胞/ml时效果较好。确保转染时细胞没有长满或处于静止期。因为转染效率对细胞密度很敏感,所以在不同实验间保持一个基本的传代步骤很重要。铺板细胞数目的增加可以增加转染活性和细胞产量。在三种不同密度进行细胞铺板的比较表明铺板密度较高的,CAT活性也较高。得到较高活性所需的LIPOFECTAMINE试剂的量也相应增加了。这些结果说明,对于转染相同量的DNA所需的较佳阳离子脂质体试剂的量会因细胞密度而异。选择传代次数较低并处于对数生长期的细胞进行转染。昆明细胞高效转染试剂供应商
对于原代细胞,可用促有丝分裂刺激物进行细胞活化。合肥细胞高效转染试剂推荐厂家
细胞转染效率低下的几个大坑:1.准备不足做脂质体转染的时候,在开展正式实验前要多做预试验,优化转染条件。优化转染条件包括:脂质体的用量、DNA密度、细胞密度、脂质体和DNA混合孵育时间等等。2.电压过大做电转的时候,如果电压太大,往往会发生细胞大量死亡的情况。不同的细胞,需要的电压是不一样的。这就要求我们多做预实验,多摸索条件。对于大多数细胞来说,其较佳电压位于250-1250v/cm。另外,就是进行转染的细胞应该处于对数生长期。处于对数生长期的细胞的抗损伤能力是较强的。细胞浓度应该处于5x106到1x107/mL之间。每次转染的质粒应该控制在4-6 μg,如果﹥10μg,转染效率也较大降低。电击后,应该将DNA和细胞混合液在室温下放置10分钟,使细胞恢复损伤。合肥细胞高效转染试剂推荐厂家
转染的注意事项:用于蛋白生产的细胞的转染可以在添加有血清或无血清培养基中进行。但更倾向于使用无血清培养基表达蛋白,因为血清蛋白会干扰下游表达蛋白的纯化。无血清培养基一般针对某一特定细胞类型优化并有几类无血清培养基不需要添加血清,一般含有不均一的或大量的蛋白(但比添加血清的培养基低得多)。无蛋白培养基不含蛋白但可能含有不明成分的抽提物,限定化学成分的培养基不含有蛋白或未知组成的成分。多种多样的配方使您可以选择较适合您应用的一种。在含血清时转染的细胞可以适应无血清培养基,无蛋白培养基或限定化学成分的培养基。在部分情况下(如293-F,293-H,COS-7和CHO-S),对于已适应无血清或无蛋白培...
- 芜湖细胞高效转染试剂哪家便宜 2026-01-28
- 青岛正规细胞高效转染试剂厂家批发价 2026-01-28
- 徐州正规细胞高效转染试剂厂家批发价 2026-01-27
- 昆明正规细胞高效转染试剂推荐厂家 2026-01-27
- 无锡细胞高效转染试剂厂家批发价 2026-01-27
- 昆明正规细胞高效转染试剂厂家直销 2026-01-27
- 苏州细胞高效转染试剂厂家现货 2026-01-27
- 长沙正规细胞高效转染试剂直销厂家 2026-01-27
- 芜湖长沙细胞高效转染试剂 2026-01-27
- 郑州细胞高效转染试剂厂家现货 2026-01-26
- 珠海细胞高效转染试剂供应商 2026-01-26
- 天津正规细胞高效转染试剂单价 2026-01-26
- 宁波正规细胞高效转染试剂价格 2026-01-26
- 广州正规细胞高效转染试剂厂家现货 2026-01-25
- 北京正规细胞高效转染试剂单价 2026-01-25
- 宁波细胞高效转染试剂 2026-01-25


- 天津RNA提取试剂产品介绍 02-01
- 南京成都RNA提取试剂 02-01
- 宁波广州细胞外基质胶 02-01
- 青岛细胞外基质胶服务电话 02-01
- 温州正规外泌体提取试剂厂家现货 02-01
- 杭州重庆细胞外基质胶 02-01
- 上海正规外泌体提取试剂厂家供应 02-01
- 天津正规外泌体提取试剂供应商 02-01
- 太原正规细胞外基质胶销售厂家 02-01
- 贵阳正规外泌体提取试剂供应商 02-01