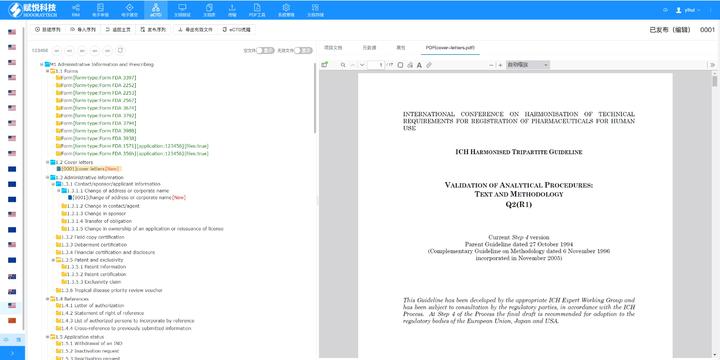
美国eCTD验证采用三级分类:“错误”(必须修正)、“警告”(建议修正)、“提示信息”(参考)。例如,PDF文件版本不符或加密保护属于“错误”,而书签路径非相对性则可能列为“警告”。验证失败将直接导致退审,企业需通过LORENZ Validator等工具预检,确保提交前合规。 技术验证点 验证涵盖XML结构合规性、文件命名规则、生命周期管理(如序列号连续性)及PDF属性(如字体嵌入、可搜索性)。临床试验数据需额外满足CDISC标准,包括SDTM和ADaM数据集的结构验证瑞士eCTD注册咨询相关技术支持。闵行区INDeCTD递交
赋悦Word插件 自主研发Word插件 快速编辑:整合word常用功能按钮,避免频繁切换菜单;内置标题、段落、文字、目录、超链接等的格式和样式,可快速设置和更文档的格式 快速链接:双击或者拖拽的方式,制作文本超链接或者题注超链接;可搜索全文关键字,自动制作超链接 文档拆分:可根据不同的条件将word文件颗粒化,如分节符、页眉、页脚、页码范围和自定义页码等 PDF转换:WORD转PDF,自动判断是否生成书签,自动镶嵌所有字体,生成PDF快速网页浏览的PDF,确保生成的PDF所有属性符合法规要求 文档验证:验证文档的字体、字号、纸张、页面布局、空白页、页码、编号、目录、超链接等,并且可以定位验证结果 可定制:可根据用户需求定制格式和样式模板宁波原料药eCTD软件瑞士DMF注册申报相关技术支持。
中国将进一步与国际接轨,推进eCTD等标准应用,提高药品注册效率和质量。AI技术可能在药品注册领域广泛应用,如辅助审评人员工作。未来药品注册资料将更注重结构化数据,有助于监管机构高效获取和利用数据。 eCTD等数字化工具将推动药品监管向智慧监管和全生命周期监管发展,提高监管效率和质量。区块链技术具有应用前景,可构建全球统一的药品申报数据平台。数据化时代,药品注册领域将更注重数据收集、分析和利用,为监管机构和企业提供决策支持。 总而言之,展望未来,随着eCTD在药品注册领域的广泛应用和不断发展,中国将逐步建立起与国际接轨的药品注册体系。这将有助于提高中国药品注册的效率和质量,推动中国药品走向世界舞台。同时,企业也需要密切关注技术发展动态和监管政策变化,及时调整自身战略和规划,以适应未来的市场竞争和监管要求。
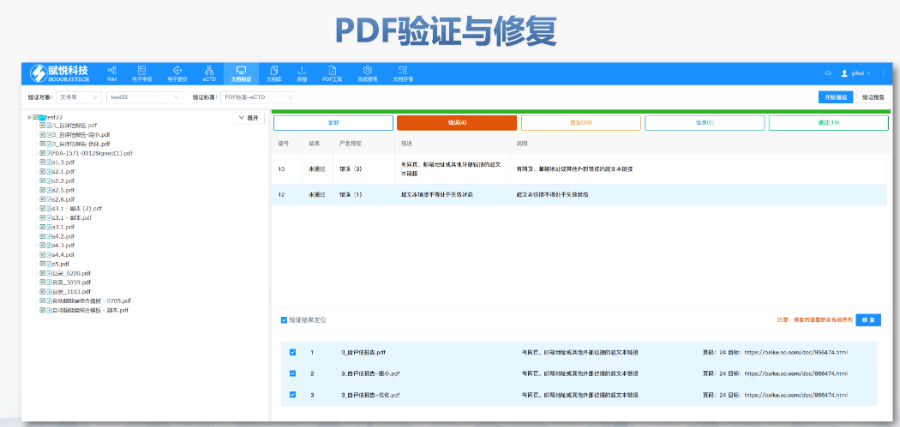
eCTD验证标准的严格性与分类:欧盟对eCTD的验证要求分为“错误”“警告”和“提示信息”三级,其中“错误”项直接导致申报被拒。验证项目涵盖六大类共149条,包括文件命名规范(如路径长度限制)、PDF可读性(禁止密码保护)、XML骨架文件完整性等。例如,文件扩展名必须符合规范(如.xpt用于临床数据集),而文件夹层级需避免空目录或混合存放文件。相较于中国《电子申报验证标准》的简化版(54条),欧盟的验证体系更为复杂,体现了其高标准的技术监管。美国IND注册申报相关技术支持。

欧盟eCTD的历史沿革与强制实施 欧盟自2003年逐步推进eCTD(电子通用技术文档)的标准化进程,初要求药注册申请(MAA)采用CTD格式。2010年,集中审评程序(CP)率先强制使用eCTD,随后分散程序(DCP)和互认程序(MRP)分别于2015年、2017年跟进。至2019年,欧盟要求所有国家程序(NP)的注册申请均以eCTD格式提交,标志着其电子递交体系的成熟。2024年,EMA启动eCTD4.0试点项目,旨在提升技术兼容性与审评效率。 eCTD验证标准的迭代与关键更 欧盟的验证标准历经多次调整,例如2025年3月启用的eCTD3.1区域模板和验证规则v8.1,对文件结构、元数据和内容完整性提出更严格的要求。标准引入的“追踪表(Tracking Table)”强制校验规则(如15.11和15.12)曾导致CEP(欧洲药典适用性证书)递交,后通过允许占位文件临时解决。与早期版本相比,v8.1强化了对模块一区域信息的逻辑验证,并细化了对PDF书签、超链接的规范性检查。欧盟CESP提交通道相关技术支持。徐汇区ANDAeCTD是什么
澳大利亚NDA注册申报相关技术支持。闵行区INDeCTD递交
2020年暴发后,FDA进一步推动电子化进程,例如允许远程电子签章和临时放宽部分格式要求,但验证标准(如PDF版本、书签链接有效性)并未降低。这一时期的实践为eCTD在紧急审批中的灵活性提供了案例,也凸显了其作为危机应对工具的价值。 尽管美国尚未部署eCTD V4.0,但其技术方向已明确:支持医疗器械和保健品申报、增强数据可复用性、优化审评系统与人工智能的集成。此外,区块链技术在电子签章和数据溯源中的应用探索,可能成为下一阶段升级的重点闵行区INDeCTD递交
赋悦科技由生物制药行业老师、医药信息化工程师以及具有丰富经验的互联网软件工程师组成,为医药行业用户提供专业的药品注册申报工具软件与服务,如eCTD系统、电子申报系统,注册管理系统,PDF工具箱等。 赋悦科技有多名药品注册顾问老师,国内重点医药院校教授,为生命科学企业提供药品、生物制品、医疗器械、化工品等注册咨询与外包服务。擅长领域包括国际药品注册,进口药品注册,中国药品注册等,成功向中国、美国、欧盟、加拿大、澳大利亚、巴西、印度、日本等10多个国家提交注册申报材料,包括DMF,CEP,ASMF,ANDA,IND等。